
- 赖红昌教授
- 上海九院口腔种植科主任
- 口腔种植支持固定修复
- 口腔种植支持活动修复等
上海九院种植牙口腔颅颌面种植科主任,教授、主任医师、博士生导师。现任中华口腔医学会口腔种植专业委员会主任委员,国际口腔种植协会专家委员会委员...[详细]
研究成果
即刻种植同期牙槽嵴保存术的数字化分析
更新时间:2019-06-27 14:34
即刻种植同期牙槽嵴保存术的数字化分析 :一项犬类动物实验研究
A digital evaluation of alveolar ridge preservation atimplants placed immediately into extraction sockets: anexperimental study in the dog
朱钰 翻译;王刃 审校
关键词 : 动物实验,骨愈合,胶原膜,无机牛骨,拔牙窝,即刻种植,种植牙科学,骨结合,再生,牙槽嵴保存术,I型种植术
摘要
目的 : 比较即刻种植同期植入无机牛骨粉和胶原膜的位点与相应的天然牙位点在骨吸收和软组织改建方面的差异。
材料与方法 : 对犬的左侧下颌第三前磨牙的近中根予以根管治疗,在该牙位点翻瓣、行牙半切术以拔除远中根后,将种植体即刻植入拔牙窝偏舌侧的位置,并同期将无机牛骨粉植于骨缺损内以及颊侧骨嵴之外,胶原膜覆于其上,然后以非埋入式愈合的方式缝合。对照组则为犬的右侧下颌骨的第三前磨牙(天然牙)的远中根。获取的组织磨片以双侧下颌第三前磨牙远中根区的种植体和天然牙根为中心,包含其周围骨质。我们通过将左侧种植位点和右侧天然牙位点的组织学图像相叠加的方式来分析两者硬组织和牙槽嵴的尺寸差异。
结果 : 经过三个月的愈合期,组织影像学分析提示种植位点比较天然牙位点软硬组织均有减少。
结论 : 在即刻种植同期通过植入无机牛骨粉和覆盖胶原膜实行的轮廓增量并不足以维持组织的量。
牙拔除术后,牙槽嵴在前3~6个月的愈合中发生明显的骨吸收,其水平宽度平均减少3.8mm、垂直高度平均降低1.2mm (Tan et al.2012)。众多研究表明,即刻种植并不足维持牙槽嵴的完整外形(Botticelli et al. 2004; Araújo et al. 2005;Sicilia & Botticelli 2012;Wang&Lang 2012)。
实验证明,种植体在拔牙窝中的植入位置是影响最终牙槽骨嵴的位置和骨量的决定性因素(Caneva etal. 2010; Tomasi et al. 2010)。种植体的植入方向越偏舌侧,种植体颈缘暴露发生得越少。然而,仅依靠种植体的植入方向并不能保存牙槽嵴。
但是,有实验论证将骨替代产品直接植入拔牙窝内(Araújo et al.2008; Lindhe et al. 2013)或在即刻种植同期植入骨缺损区(Araújo et al.2011; Caneva et al. 2011a,b,2012)有助于保存牙槽嵴。
有学者通过激光扫描手术前及愈合后的石膏模型,并用软件叠加所得图像观察到牙拔除后(Fickl etal. 2008)和即刻种植后(Caneva et al.2012; Rossi et al. 2013)牙槽骨嵴的吸收。
已有文献报道了对于即刻种植后的位点和天然牙位点的牙槽嵴的比 较(Araujo et al. 2005; Vignolettiet al. 2012)。还有一些研究将包含天然牙的牙槽嵴在植骨前后通过组织学图像进行了比较(Araujo et al.2008; Araujo & Lindhe 2009, 2011; Lindhe et al. 2013)。在这些研究中,牙根尖位置和牙轴向均被用作治疗前后图像比较的参照点。
但是,目前尚未有实验把即刻种植的位点与对侧同名天然牙位点进行比较。因此,本实验的目的是比较即刻种植同期植入无机牛骨粉覆盖胶原膜的位点与相应的天然牙位点在骨吸收和软组织改建方面的差异。
材料与方法
本实验方案经过巴西圣保罗洲立大学动物实验伦理委员会批准。
临床处理
本实验使用了6只拉布拉多犬(重量均约为26.5kg,年龄均约为1岁)。
在外科操作中,所有动物均预先接受了麻醉剂(0.2% Acepran®,0.05 mg/kg,Univet-vetnil, Sao Paulo,Brazil)和镇静剂(Zoletil®,10 mg/kg,Virbac, JurubatubaSanto-Amaro, Brazil),术中予以异氟醚(Baxter Hospitalar Ltd., Sao Paulo, Brazil)吸入麻醉。在手术全程,所有动物均以无菌生理盐水静脉滴注。术中还采用了局部麻醉。
左侧下颌(实验侧)第三前磨牙近中根的牙髓组织被去除,根管充填牙胶尖和根充糊剂(Adonis®, Sweden& Martina, Due Carrare, Padova, Italy)。行牙冠半切术后,拔除远中根,牙冠用复合树脂(Adonis®, Sweden& Martina, Due Carrare, Padova, Italy)修复。从颊舌侧各翻开全厚瓣,使颊舌侧牙槽骨板暴露,并用卡尺测量近冠方的颊舌向骨嵴的宽度(Castroviejo®; KLS Martin Group, Umkirch, Germany)。在相应位点备洞完成后,在远中根的牙槽窝内植入TiUnite®表面钛种植体(Nobel Biocare Holding AG, Kloten, Switzerland; MarkIII Groovy implant, 11.5mm long and 3.3mm wide)( 图1a)。种植体的植入位置偏向牙槽嵴的舌侧,种植体的边缘与牙槽嵴的边缘齐平,种植体与颊侧骨面间存在一个颊侧间隙。颊侧牙槽骨和种植体之间骨缺损区的水平宽度(H-GAP)和垂直深度(V-GAP)均使用UNC 15TM探针(Hu-Friedy, Chicago, IL, USA)进行测量。所有种植体的肩台(implant shoulder,IS)均位于舌侧牙槽骨嵴偏根方的位置。在舌侧,牙槽骨嵴顶(C-Clinical)到种植体肩台(IS)的距离也使用同一牙周探针进行测量。愈合基台被固定到种植体上后,无机牛骨粉(Bio-Oss®, Granules0.25~1mm; Geistlich Biomaterials, Wolhusen, Switzerland)被填充在种植体边缘周围的骨缺损区和颊侧骨面外。 胶 原 膜(Bio-Gide®; Geistlich Biomaterials)被 覆 盖于颊侧面(图1b)。随后对黏膜瓣进行减张处理,并以VicrylTM 4-0缝线进行间断缝合,使种植体以非埋入式愈合(Johnson & Johnson, Sao Jose dos Campos, Brazil)。
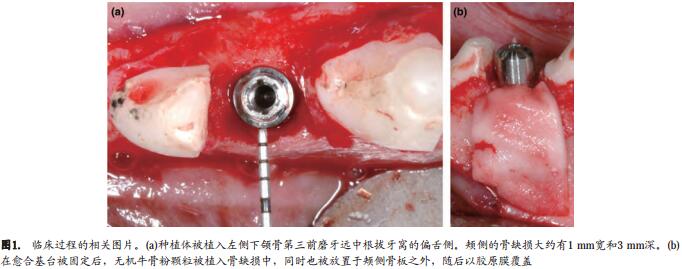
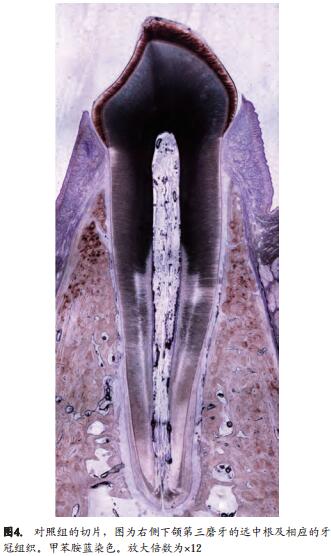
右侧下颌第三磨牙没有进行任何处理,以作为对照。
在手术后,所有动物被给予抗生素(Stomorgyl®10,1片/10kg每天,Merial Saude Animal Ltd.,Paulinia, Brazil)口 服10天、 抗 炎 药(Maxicam® 2.0 mg,1片/20 kg每天,Ouro Fino Saude Animal Ltd.,Cravinhos,Brazil)口 服5天、 止 疼 药 口 服3天(Tramal® 50 mg,4.0mg/kg每8小时皮下注射,Uniao Quimica Farmaceutica Nacional S/A,Pouso Alegre,Brazil)。所有的实验动物均被饲养于狗舍中并于实验室中进行规律的运动。所有的实验动物均可随意进水,并予以湿润的、均衡的狗粮。
每天实验人员会检查伤口愈合情况、防止并发症,并清洁愈合基台。在手术3个月后,所有动物均以注射过量硫喷妥钠的方式使其安乐死。
组织学制备
将含有种植体的骨块(左侧)或含有天然牙的骨块(右侧)以及其周围的软硬组织置于4%的福尔马林溶液中以固定,随后以一系列不同浓度的乙醇进行脱水处理,并最终将其置于树脂中(LR White® hard grade,London Resin Company Ltd, Berkshire, UK)包埋。以固定于精密切割机中(Exakt®, Apparatebau, Norderstedt,Germany)的金刚石锯以种植体/牙为中心,沿其长轴于颊舌平面对骨块进行切割。然后,从切开一半的骨块中各获取一片切片并用切削器械(Exakt®, Apparatebau)将其磨至50 μm厚。最后,种植体和天然牙最中心位置的切片被挑选出来并用于组织学分析。
用甲苯胺蓝对组织学切片进行染色并用标准光学显微镜对其进行组织学分析。
组织学分析
使用配置有摄像机并与电脑连接的Eclipse 50i光学显微镜(Nikon Corporation,Tokyo, Japan)进行组织学分析,分析软件为NIS-Elements v4.1软件(Nikon Corporation)。标志性位点分别位于实验位点(如图2所示)的种植体肩台(IS),种植体相邻的牙槽嵴的顶端(C),硬组织最冠方的位置—可能是骨或无机牛骨粉颗粒(Cbt)和骨-种植体接触面最冠方处(B)。
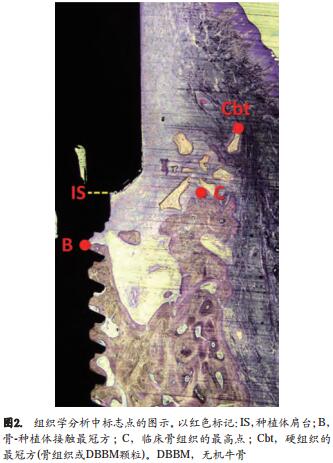
在100倍的放大倍数下测量以下标志点间的垂直距离 : IS-C,IS-Cbt和IS-B。
影像学分析
拍摄记录所有的组织学切片,并将实验组和对照组的图片进行叠加,保证种植体的舌侧面与对照组的舌侧骨壁相互平行。种植体肩台与颊侧的牙槽骨面存在一定宽度的骨缺损,此宽度与临床数据观察到的一致。
根据固定标志点的位置,用i-Dixel软件(J. MoritaMfg. Corp., Kyoto, Japan)将图片进行匹配。专用软件(ImageJ 1.34)被用以进行测量,以种植体的尺寸为参照,将测量的像素单位转换为毫米。
逐一辨认以下种植体/天然牙唇舌侧面标志点(如图3所示) :种植体肩台(IS)、种植体表面(S)、种植体周围粘膜的最高点(PM)、牙龈的最高点(G)、骨缺损的底部(D)。此外,我们还确定了牙槽骨嵴和粘膜的外形轮廓,以及拔牙窝/残留骨缺损和黏膜/牙龈的内轮廓(IC)。
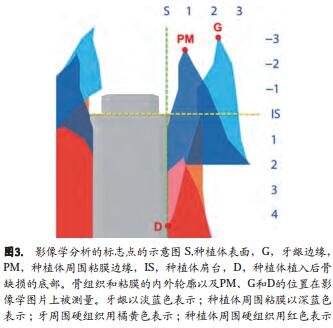
测量PM-IS和G-IS间的垂直距离,并测量在IS水平种植体表面(S)到硬组织的内外轮廓的水平距离,然后向根方每隔1毫米测量一次水平距离,直至达到根方4毫米。类似的,我们测量了在IS水平种植体表面到黏膜组织的内外轮廓的水平距离,向冠方每隔1毫米测量一次水平距离直至达到冠方3毫米、再向根方每隔1毫米测量至根方2毫米。我们按这个方法分析了整个颊侧面和舌侧面近冠方的位置。
统计学分析
结果变量的平均值、标准差、 25%区间、 50%区间(中位数)、 75%区间均被统计。以Wilcoxon符号秩检验对实验组和对照组的数据进行统计学分析,P<0.05为具有统计学差异。
结果
临床测量
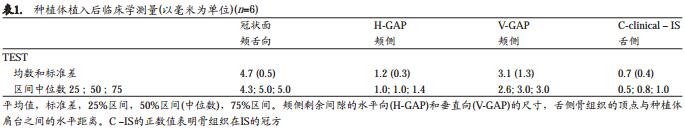
表格1为临床测量的结果。拔牙窝的尺寸是4.7±0.5mm,即刻种植后水平骨缺损(H-GAP)和垂直骨缺损(V-GAP)分别是1.2±0.3mm和3.1±1.3mm,IS在舌侧骨边缘嵴根方约0.7mm的位置。
经过3个月的愈合期后,没有种植体脱落,也没有明显的炎症症状。
组织学分析
在组织学切片的制备过程中无异物掺杂,实验组和对照组的切片均无损毁。所有的种植体均与天然的矿化骨结合。
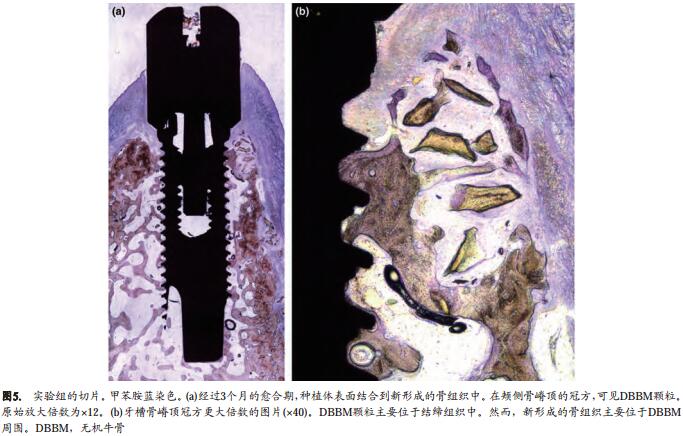
实验组颊侧牙槽骨嵴吸收了1.7±1.1mm (图4a,b;表2)。在舌侧面,牙槽骨嵴的顶点在IS根方的0.5±0.7mm。但是,考虑到最初舌侧牙槽骨嵴的位置,确切的垂直骨吸收达到了1.2±0.5mm(1-absolute)。
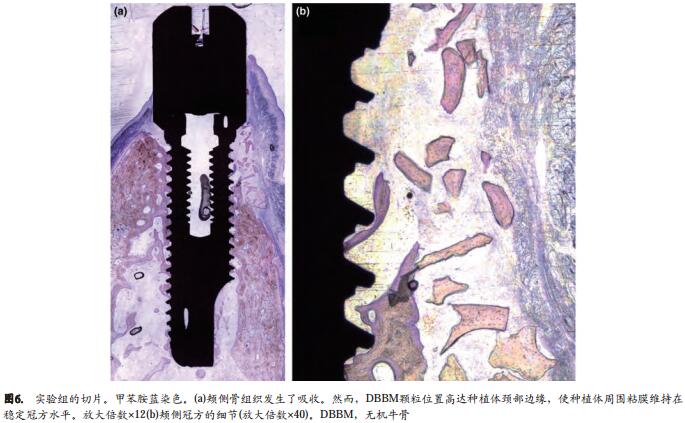
几乎没有发现无机牛骨粉结合入形成的新骨。但是,在牙槽骨嵴上方和牙槽骨嵴的外侧,我们观察到一些颗粒进入到结缔组织,这些颗粒似乎有助于维持种植体周围粘膜的冠方位置(图5a,b)。 IS和硬组织(骨或无机牛骨粉)的最冠方(Cbt)之间的距离是1.1±1.7mm(IS-Cbt),而IS-B(骨-种植体接触面最冠方处)之间的距离是2.3±1.3mm。
影像学分析
实验组和对照组均为6组影像。图6展示的是对照组的一张代表性切片。
通过对实验组和对照组图片的叠加与分析,我们发现实验组颊侧软硬组织均出现退缩,同时颊侧骨缺损程度有所减小。相关标记点如图3所示。图7a-d以图解说明相应的标记点测量。在颊侧面,代表了即刻种植后颊侧骨缺损的垂直距离IS-D(缺损的底部)是4.4±0.7mm。
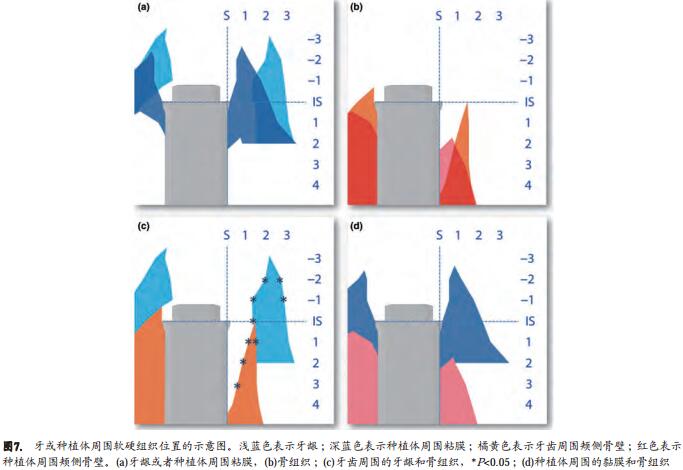
讨论
本实验主要评价了即刻种植同期将无机牛骨粉植入约1mm的边缘骨缺损内以及颊侧骨面之外并以胶原膜覆盖对颊侧牙槽骨保存的影响。
在骨缺损区以及颊侧骨面的骨增量手术未能维持软硬组织的量。
类似的犬类实验曾证实,与未处理的拔牙窝相比,即刻种植对保存牙槽嵴所起的作用是十分有限的(Caneva et al. 2012; Favero et al. 2013a)。然而,另一项类似研究得出了不同的结论(Araújo et al. 2011),这项研究论证了在过度的位点其颊侧牙槽骨不会发生垂直向吸收。
尽管我们的实验清楚地证明了即刻种植同期骨增量手术不能够维持软硬组织的量,其他一些实验曾证实使用骨增量手术可以限制即刻种植后组织的萎缩(见Wang & Lang的综述)。在即刻种植过程中,无机牛骨粉的使用在较小的骨缺损中效果较好。 Caneva等(2011a)的实验也使用了第三前磨牙且颊侧骨缺损大约为0.6mm,相对于对照组,他们的实验组在牙槽嵴保存方面取得了较好的效果。在Favero等(2013)的实验中,颊侧骨缺损大约1.7mm,他们观察到相似的结果。最后,还有实验将无机牛骨粉应用于第一磨牙的拔牙窝内,该实验中且颊侧骨缺损的面积大约为2.5~2.7mm,他们发现对照组比实验组(植入了骨粉)效果更好,这表明在超过2mm的骨缺损区域,用无机牛骨粉和胶原膜来行牙槽嵴保存术的效果很差(Favero et al. 2013b)。
在本实验中,临床学观察显示颊侧骨缺损的宽度大约为1.2mm,深度大约为3.1mm。影像学观察则显示骨缺损的深度大约为4.4mm。这两个检测手段所得数据的差异可能是因为探针的尖端无法触及骨缺损区的底部。
另外一项犬类实验表明,无机牛骨粉可能有助于软组织冠方高度的保存,在该实验中即刻种植位点也是下颌第三前磨牙(Caneva et al. 2012)。在这个实验中,实验组一侧的区域用无机牛骨粉和胶原膜进行了GBR,而对照侧则没有进行GBR。研究人员在拔牙前和拔牙4个月后均制取了印模,将这两个阶段的3D的图片进行叠加并比较了它们之间的尺寸差异。他们发现,虽然植入DBBM和胶原膜并不足以维持原始的尺寸,但是实验组(植入DBBM和胶原膜)在保存颊侧牙槽嵴的骨量方面还是具有一定的优势。类似实验也证明,相对于单纯植骨或没有植骨的对照组,使用DBBM和胶原膜在即刻种植位点在牙槽嵴保存方面有一定优势(Cornelini et al. 2004; Chen et al. 2007)。
在本实验中,IS到硬组织的顶端和IS到骨组织的顶端的距离存在一定差异。这也说明,硬组织的顶端是由位于结缔组织中的DBBM颗粒组成的,而这可由组织学分析证实。这和Favero等(2013b)的实验结果相一致,该实验研究犬类磨牙区即刻种植后的骨改建的情况。他们在即刻种植后剩余骨缺损>2mm的区域用DBBM充填并以胶原膜覆盖,结果实验组硬组织的的顶点比骨组织的顶点更偏冠方0.6mm。这可能是因为,拔牙后由于颊侧骨板的吸收导致骨粉不能融入新形成的骨组织。
另一项狗的上颌侧切牙区进行即刻种植的实验也分析了位于牙槽骨嵴最冠方以上的DBBM颗粒,该研究在人造的标准化骨缺损区植入了DBBM或者自体骨并以胶原膜覆盖(De Santis et al. 2011)。经过2个月的愈合期,牙槽骨嵴的顶端和DBBM的顶端分别位于IS的根方2mm和0.9mm。然而,经过4个月的愈合期,牙槽骨嵴和DBBM/硬组织的最高点位于相同的高度(2.5~2.6mm),这说明2个月时靠近冠方的DBBM颗粒在4个月时已经消失。这可能与结缔组织中的骨粉的吸收十分活跃相关(Busenlechner et al.2012)。
在本实验中,种植体在牙槽嵴的偏舌侧位置植入。实验已经表明,相对于更加中心或偏颊侧的位置,偏舌侧植入在一定程度上有助于减少种植体颊侧颈缘的暴露(Caneva et al. 2010; Tomasiet al.2010; Favero et al.2012)。
在这个实验中,通过叠加天然牙位点和对侧实验的图片,我们分析了相应尺寸的变化。这种实验位点和天然牙位点的比较也出现在其他一些研究中(Araújo& Lindhe 2009, 2011; Lindhe et al. 2013)。这些研究对充填了植骨材料的拔牙窝与没有做任何处理的天然牙位点进行了比较。其中,实验组均为前磨牙远中根的拔牙窝,对照组则是近中根位点。而在本实验中,实验组和对照组都以远中根为研究位点,这更加保证了两组在基线尺寸上的一致性。
综上所述,本实验说明即刻种植同期通过植入无机牛骨粉和覆盖胶原膜而进行的外形增量并不足以维持组织的量。
致 谢 : This study has been supported by ARDEC, AriminumOdontologica SRL, Rimini, Italy. Implants and components wereprovided by Nobel Biocare Holding AG, Kloten, Switzerland.DBBM particles and collagen membranes have been kindly provided by Geistlich Biomaterials AG, Wolhusen LU, Switzerland.The competent contributions of Prof. Luiz Antonio Salata and Mr.Sebastião Bianco (USP - Faculty of Dentistry of Ribeirão Preto-University of São Paulo, São Paulo, Brazil) in the histological processing are highly appreciated. All the authors declare to have noconflict of interest with the materials used in the present study.
参考文献
Araújo, M.G., Linder, E. & Lindhe, J. (2011) Bio-Oss® Collagen in the buccal gap at immediate implants: a 6-months study in the dog. Clinical OralImplants Research 22: 1–8.
Araújo, M.G., Linder, E., Wennström, J. & Lindhe, J. (2008) The influenceof Bio-Oss collagen on healing of an extraction socket: an experimentalstudy in the dog. The International Journal of Periodontics & RestorativeDentistry 28: 123–135.
Araújo, M.G. & Lindhe, J. (2009) Ridge preservation with the use of BioOss collagen: a 6-month study in the dog. Clinical Oral Implants Research 20: 433–440.
Araújo, M.G. & Lindhe, J. (2011) Socket grafting with the use of autologousbone: an experimental study in the dog. Clinical Oral Implants Research 22: 9–13.
Araújo, M.G., Sukekava, F., Wennström, J.L. & Lindhe, J. (2005) Ridgealterations following implant placement in fresh extraction sockets: anexperimental study in the dog. Journal of Clinical Periodontology 32:645–652.
Botticelli, D., Berglundh, T. & Lindhe, J. (2004) Resolution of bone defectsof varying dimension and configuration in the marginal portion of theperi-implant bone. An experimental study in the dog. Journal of ClinicalPeriodontology 31: 309–317.
Busenlechner, D., Tangl, S., Arnhart, C., Redl, H., Schuh, C., Watzek, G. &Grube.r, R. (2012) Resorption of deproteinized bovine bone mineral in aporcine calvaria augmentation model. Clinical Oral Implants Research23: 95–99.
Caneva, M., Botticelli, D., Morelli, F., Cesaretti, G., Beolchini, M. & Lang,N.P. (2012) Alveolar process preservation at implants installed immediately into extraction sockets using deproteinized bovine bone mineral – anexperimental study in dogs. Clinical Oral Implants Research 23: 789–796.
Caneva, M., Botticelli, D., Pantani, F., Baffone, G.M., Rangel, I.G. Jr &Lang, N.P. (2011a) Deproteinized bovine bone mineral in marginal defectsat implants installed immediately into extraction sockets. An experimentalstudy in dogs. Clinical Oral Implants Research 23: 106–112.
Caneva, M., Botticelli, D., Stellini, E., Salata, L.A., Souza, S.L.S. & Lang,N.P. (2011b) Magnesiumenriched hydroxyapatite at immediate implants.A histomorphometric study in dogs. Clinical Oral Implants Research 22:512–517.
Caneva, M., Salata, L.A., de Souza, S.S., Baffone, G., Lang, N.P. & Botticelli, D. (2010) Influence of implant positioning in extraction sockets onosseointegration: histomorphometric analyses in dogs. Clinical Oral Implants Research 21: 43–49.
Chen, S.T., Darby, I.B. & Reynolds, E.C. (2007) A prospective clinical studyof non-submerged immediate implants. Clinical outcomes and estheticresults. Clinical Oral Implants Research 18: 552–562.
Cornelini, R., Cangini, F., Martuscelli, G. & Wennström, J. (2004) Deproteinized bovine bone and biodegradable barrier membrane to supporthealing following immediate placement of transmucosal implants: a shortterm controller clinical trial. The International Journal of Periodontics &Restorative Dentistry 24: 555–563.
De Santis, E., Botticelli, D., Pantani, F., Pereira, F.P., Beolchini, M. & Lang,N.P. (2011) Bone regeneration at implants placed into extraction socketsof maxillary incisors in dogs. Clinical Oral Implants Research 22: 430–437.
Favero, G., Botticelli, D., Favero, G., García, B., Mainetti, T. & Lang, N.P.(2013a) Alveolar bony crest preservation at implants installed immediately after tooth extraction: an experimental study in the dog. Clinical OralImplants Research 24: 7–12.
Favero, G., Lang, N.P., De Santis, E., Garcia Gonzalez, B., Schweikert, M.T.& Botticelli, D. (2013b) Ridge preservation at implants installed immediately after molar extraction. An experimental study in the dog. ClinicalOral Implants Research 24: 255–261.
Favero, G., Lang, N.P., Favero, G., Grau León, I., Salata, L.A. & Botticelli, D.(2012) Role of teeth adjacent to implants installed immediately into extraction sockets. An experimental study in the dog. Clinical Oral ImplantsResearch 23: 402–408.
Fickl, S., Zuhr, O., Wachtel, H., Bolz, W. & Hürzeler, M.B. (2008) Hardtissue alterations after socket preservation: an experimental study in thebeagle dog. Clinical Oral Implants Research 19: 1111–1118.
Lindhe, J., Araújo, M.G., Bufler, M. & Liljenberg, B. (2013) Biphasic alloplastic graft used to preserve the dimension of the edentulous ridge:an experimental study in the dog. Clinical Oral Implants Research 24:1158–1163.
Rossi, F., Romanelli, P., Ricci, E., Marchetti, C. & Botticelli, D. (2013) Acone-beam tomographic evaluation of hard tissue alterations at immediateimplants. A clinical prospective study. The International Journal of Periodontics & Restorative Dentistry 33: 815–823.
Sicilia, A. & Botticelli, D. ; Working Group 3 (2012) Computer-guidedimplant therapy and soft- and hard-tissue aspects. The Third EAO Consensus Conference 2012. Clinical Oral Implants Research 23 (Suppl 6):157–161.
Tan, W.L., Wong, T.L., Wong, M.C. & Lang, N.P. (2012) A systematic review of post-extractional alveolar hard and soft tissue dimensional changes in humans. Clinical Oral Implants Research 23 (Suppl 5): 1–21.
Tomasi, C., Sanz, M., Cecchinato, D., Pjetursson, B., Ferrus, J., Lang, N.P.& Lindhe, J. (2010) Bone dimensional variations at implants placed infresh extraction sockets: a multilevel multivariate analysis. Clinical OralImplants Research 21: 30–36.
Vignoletti, F., Discepoli, N., Müller, A., de Sanctis, M., Muñoz, F. & Sanz,M. (2012) Bone modelling at fresh extraction sockets: immediate implantplacement versus spontaneous healing: an experimental study in the beagle dog. Journal of Clinical Periodontology 39: 91–97.
Wang, R. & Lang, N.P. (2012) Ridge preservation after tooth extraction.Clinical Oral Implants Research 23 (Suppl 6): 147–156.



