
- 赖红昌教授
- 上海九院口腔种植科主任
- 口腔种植支持固定修复
- 口腔种植支持活动修复等
上海九院种植牙口腔颅颌面种植科主任,教授、主任医师、博士生导师。现任中华口腔医学会口腔种植专业委员会主任委员,国际口腔种植协会专家委员会委员...[详细]
研究成果
相关文章
六种不同种植体表面成形术的种植体表面粗糙度及处理时间
更新时间:2019-06-27 14:36
六种不同种植体表面成形术的种植体表面粗糙度及处理时间
Surface roughness of dental implants and treatmenttime using six different implantoplasty procedures
张晓梦 翻译;庄龙飞 审校
关键词 : 牙种植体,种植体表面改性,种植体表面成形术,种植体周围炎,表面粗糙度测量法,种植体周围炎切除术,钻针
摘要
目的 : 比较六种不同的种植体表面成形术的方法,观察何种方法能够以最短的处理时间最大限度地降低种植体表面粗糙度。
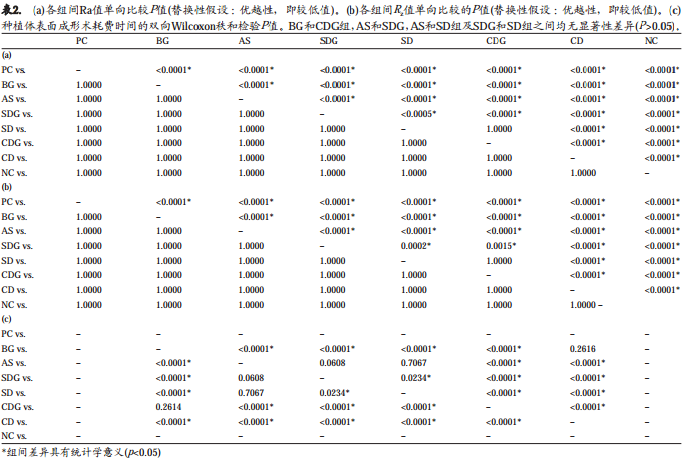
材料与方法 : 将42个一体式种植体的底部包埋固定于环氧树脂块内,暴露种植体颈部6 mm粗糙表面,用以下6种种植体表面成形系统对种植体暴露表面进行抛光: Brownie®,, Greenie® (BG) (选用106、 40、 15 μm粒度的金刚砂车针,Brownie®, Greenie®硅树脂抛光车针) ; Arkansas stone(AS)(106、 40、 15 μm粒度金刚砂车针,阿肯色石鱼雷状车针) ; Short diamond(SD)(106、 40、 4 μm粒度金刚砂车针) ; Short diamond with Greenie®(SDG)系列(106、 40、 4 μm粒度金刚砂车针, Greenie®) ; Complete diamond(CD)系列(106、 40、 15、 8、 4 μm粒度金刚砂车针) ; Complete diamond with Greenie®(CDG)系列(106、 40、 15、 8、4 μm粒度金刚砂车针, Greenie®)。以抛光的种植体颈部为阳性对照,而未经处理的大颗粒酸蚀喷砂的(SLA)种植体表面作为阴性对照。每一个实验种植体由接触式表面光度计扫描,得出表面粗糙度,以Ra值和Rz值表示。实验者记录每组种植体表面抛光所需时间,采用Kruskal–Wallis-检验分析6组间的差异,并采用Wilcoxon秩和检验对各组两两比较。
结果 : Ra均值得出如下 : BG组0.32 ± 0.14 μm, AS组0.39± 0.13 μm, SDG组0.59 ± 0.19 μm, SD组0.71 ± 0.22 μm, CDG组0.75 ± 0.26 μm, CD组0.98 ± 0.30μm,阳性对照(PC)组0.10 ± 0.01 μm和阴性对照(NC)组1.94 ± 0.47 μm。两两配对的单向比较显示实验各组之间具有统计学差异(P<0.05)。 AS组的处理时间最短,为13 ± 2分钟,而CDG组和BG组的处理时间最长,分别达21 ± 2分钟和21 ± 4分钟。
结论 : 结合种植体最终表面粗糙度和处理时间这两个方面因素,本实验中,AS组采用金刚砂车针和阿肯色石车针是较佳的种植体表面成形处理方式。
种植体周围炎最初定义为种植体周围组织的一种感染性病变 (Levignac 1965; Mombelli et al.1987)。后专指发生在完成骨结合,并处于负载状态下的种植体周围的一种炎症破坏性病变,可导致种植体周围袋的形成以及骨的进行性丧失(Albrektsson & Isidor 1994)。 据统计,在种植体植入5~10年后,大约有10%的种植体发生种植体周围炎,累及患者达到20%左右(Mombelli et al. 2012)。在众多因素中,吸烟和牙周炎病史与种植体周围炎的发生密切相关(Galindo-Morenoet al. 2005; Heitz-Mayfield 2008;Roccuzzo et al. 2010, 2012)。 由于种植体周围炎能破坏骨结合导致种植体脱落,因此必须对其采取干预措施,阻止种植体周围炎的发展,并对组织进行再生治疗,以期“恢复原状”。
目前,虽然尚无公认标准或具有循证支持的种植体周围炎治疗方法(Renvert et al. 2012),但是一些病例的系列报道和临床研究发现,以切除修整术(resective)(Romeo et al. 2005, 2007),或切除修整联合骨再生术(Suh et al. 2003; Schwarz et al. 2011, 2014; Matarasso etal. 2014)结合种植体表面改性,即“种植体表面成形术” (implantoplasty),有很好的治疗效果。
种植体周围炎切除术能够减小炎症反应的程度,并通过减少袋深来重建生物学宽度。为了获得种植体周围良好的骨形态,除了需要进行软组织切除和骨修整外,还需进行种植体表面成形术。常规种植体表面成形术是利用高速旋转器械去除种植体表面的螺纹,并抛光其粗糙表面。经过处理,不仅能够去除钛种植体最外的玷污层,获得无菌的表面结构。而且,降低种植体表面粗糙度也有利于减少表面菌斑的再附着。
在临床常规操作中,我们一般先以金刚砂车针或者钨钢骨刀(由钨和碳合金构成)去除种植体表面暴露在外的螺纹,然后用硅树脂抛光车针进一步抛光粗糙表面(Romeo et al. 2005, 2007; Schwarz et al. 2011, 2014;Meier et al. 2012)。最近的一个临床案例系列研究中,研究者在使用金刚砂车针后,再使用阿肯色车针进一步减小种植体表面粗糙度(Matarasso et al. 2014),然后再进行抛光程序。一些临床自身对照研究表明,最终粗糙度Ra的适宜阈值为0.2 μm (Bollen et al. 1996; Quirynen et al. 1996),即粗糙度低于这个阈值时,抛光便不能再显著减少菌斑量或菌落的致病性(Bollen et al.1996; Quirynen et al. 1996)。种植体表面成形术除却是一个非常耗时的工作外,其过程中产生的种植体碎屑(即污染的钛颗粒)和车针所产生的碎屑会分散在种植体周围的软硬组织中。钨钢和金刚砂涂层的车针比钛坚硬,因而不易剥脱,然而硅树脂抛光车针却能产生大量的硅颗粒,引发机体的免疫反应从而干扰治疗后的愈合过程。这也就解释了为什么一些研究者弃用硅树脂抛光车针,转而使用阿肯色车针的原因(Schwarzet al. 2011, 2014)。综上所述,实验的最终目的应该是优化种植体表面成形术的抛光步骤,最大程度减少碎屑产生,并缩短治疗时间。
因此,本实验的目的就是比较六种不同的种植体表面成形术方法,评估何种方法能够在最短时间内取得最低的种植体表面粗糙度。
材料与方法
种植体
将42个种植体(软组织水平美学,常规颈部,SLA®,直径4.8mm,长10mm; Institut Straumann AG,Basel, Switzerland)底部包埋入环氧树脂块(1.5×1.5 ×1.5cm),暴露颈部6 mm的粗糙面,以模仿种植体周水平骨缺损,形成骨上袋模型。实验采用钻针和抛光车针来实施六种不同的种植体表面成形术。工业预成的抛光颈部作为阳性对照(PC),而未处理的大颗粒酸蚀表面作为阴性对照(NC)。
钻针
在持续水冷却下使用以下钻针 : (i)依次使用106,40, 15 μm粒度短颈花蕾形金刚砂车针(Intensiv SA,Montagnola, Switzerland),每分钟200,000转 ; (ii)依次使用8 μm和4 μm粒度长颈火焰状金刚砂车针(IntensivSA),每分钟40,000转 ; (iii)白色氧化铝材质,鱼雷状阿肯色石车针(Jota AG, Ruti, Switzerland),每分钟20,000转; (iv)硅树脂材质,细砂状抛光车针(Brownie®,Greenie®, Shofu Dental GmbH, Ratingen, Germany),每分钟20,000转。
种植体表面成形术步骤
实验组见下列六个不同步骤 :
BG组 为Brownie®, Greenie®系 列(选 用106, 40, 15μm粒度的金刚砂车针, Brownie®, Greenie®)
AS组为Arkansas stone系列(106, 40, 15 μm粒度金刚砂车针,阿肯色石车针)
SD组为Short diamond系列(106, 40, 4 μm粒度金刚砂车针)
SDG组为Short diamond系列加上Greenie®系列(106,40, 4 μm粒度金刚砂车针, Greenie® )
CD组为Complete diamond系列(106, 40, 15, 8, 4 μm粒度金刚砂车针)
CDG组为Complete diamond加上Greenie®系列(106,40, 15, 8, 4 μm粒度金刚砂车针, Greenie®)。
工业处理抛光的种植体颈部作为阳性对照(PC),而粗糙的大颗粒酸蚀喷砂的种植体表面(骨内部分)作为阴性对照(NC)。
经校准的同一个研究者在标准化条件下,采用手持式反角手机,并在充分水冷却下实施所有种植体表面成形术(每组6个种植体)。当使用粒度≥15 μm的金刚砂车针时,保持手机转速每分钟200,000转 ;对于其他车针,最大转速控制在每分钟40,000转以内。各组的种植体表面成形术,均由粗到细,依次使用车针处理暴露的种植体表面,直至肉眼观察下表面均匀一致。每一个种植体都使用全新的车针处理。每个种植体抛光过程的总耗时以分钟为单位分组记录(图1a–d)。

表面粗糙度测量
每个种植体使用触针式表面光度仪(Mahr Perthometer S2; Mahr, Gottingen, Germany)扫描测量得出其粗糙度。包埋有种植体的环氧树脂块固定以后,光度仪的金刚石触针与种植体表面接触并呈直角,而后顺着种植体长轴在种植体的表面沿着一条直线恒速恒压扫描测定其粗糙度(表面光度仪共扫描测量2.143 mm的长度,取这段长度的中1/3为终值)。然后计算得到以下的粗糙度参数 :
Ra(粗糙度算术平均值) : Ra是基于参考路径的中心线,测得的成形术后表面粗糙度所有绝对值的平均数。
Rz(平均粗糙度) : Rz是在测量路径所测得种植体表面粗糙度值中,取最高的五个值和最低的五个值,最终求得其差值的算术平均值。
光度仪的触针接触到种植体不规则的表面,引起触针的垂直向运动,这些运动被导入传感器,产生相应的电刺激,继而被转化为数据并被记录。本实验在种植体的4个轴面进行测量,每个轴面平行地测量5次,即每个种植体获得20个粗糙度值。种植体每个轴面的两端0.714 mm范围的测量值不计算入内。
统计分析
所有的数据均由R 3.1.0 (The R Foundation for Statistical Computing, Vienna, Austria, www.R-project.org)进行统计分析。
由于数据呈非正态分布,本实验采用非参数方法进行分析。实验根据Shapiro–Wilk’s检验来计算Q-Q图和P值(P<0.0001*, Ra, Rz),检验其缺乏正态性。
本实验采用Kruskal–Wallis检验对6组数据进行比较。组间比较采用Wilcoxon秩和检验,并用Holm’s方法校正多重检验。显著性水平设定为0.05。
结果
Ra和Rz均为自变量并呈非正态分布。所有的描述性数据见表1,而且表2(a, b, c)列出了统计分析包括P值。
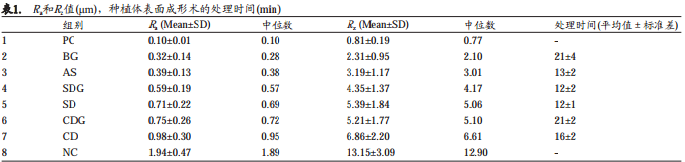
表面粗糙度
按升序排列, 实验组的Ra均值分别为 : BG组0.32±0.14 μm, AS组 0.39±0.13 μm, SDG组 0.59±0.19μm, SD组0.71±0.22 μm, CDG组0.75±0.26 μm, CD组0.98±0.30 μm。对照组的Ra均值分别为PC组0.10±0.01μm, NC组1.94±0.47 μm。实验组和对照组相比具有显著性差异(P<0.0001*)。六个实验组和两个对照样本之间两两配对的单向比较见于表2a。 BG组(替换性假设 :优越性即更低的值)明显优于其他各组和阴性对照组(图2,表2a)。
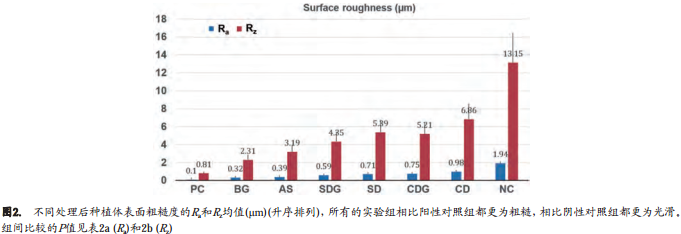
实验组的Rz均值分别为 : BG组2.31±0.95μm, AS组 3.19± 1.17μm, SDG组 4.35±1.37μm, CDG组 5.21±1.77μm, SD组 5.39 ±1.84μm, CD组 6.86 ± 2.20μm。对照组的Rz均值分别为PC组0.81±0.19μm, NC组13.15± 3.09μm。六个实验组和两个对照样本之间两两配对单向比较见于表2b。 BG组(替换性假设 :优越性也即更低的值)明显优于其他各组和阴性对照组(图2,表2b)。
处理时间
耗费时间较短的车针系列为AS组(13 ± 2 min)、SD组(12 ± 1 min)和SDG组(12 ± 1 min)(表2c)。而CDG组和BG组的处理时间最长分别达(21 ± 2 min)和(21 ± 4min),大约多花了将近70%的时间。
讨论
由实验结果可知 : (1)所有实验组的操作均降低了SLA表面的粗糙度 ; (2)各组实验操作后得到的最终表面粗糙度(以Ra值、 Rz值表示)和所耗费时间差异明显。
当种植体的粗糙面暴露于口腔环境中时,其表面粗糙度和自由能会极大地促进生物膜中细菌的集聚(Teughels et al. 2006),导致种植体周围炎的发生发展(Dohan Ehrenfest et al. 2011)。对比这两种表面性能影响的研究发现,表面粗糙度的作用更为主要(Teughelset al. 2006)。 Ra值是最常用的表面粗糙度参数,但Ra值并不能完全描述表面形貌的细节。 Ra值是通过表面光度仪的触针沿单一方向扫描物体不规则表面所得,因而其精确度受触针针尖的形态和大小的影响(Wennerberg & Albrektsson 2000)。在本研究中,种植体的光滑颈部可作为阳性对照,从而校正了实验组种植体的粗糙度值。
许多临床自身对照研究报道了最终粗糙度的阈值(Ra值为0.2 μm)(Bollen et al. 1996; Quirynen et al. 1996)。当粗糙度低于这个阈值时,抛光便不能再明显减少菌斑的总量或菌落的致病性(Bollen et al. 1996; Quirynenet al. 1996)。最近的一项研究对比了不同旋转性器械抛光种植体表面的效能与效率(Meieret al. 2012)。这项研究主要使用了硬质合金骨刀和金刚砂车针对一体式种植体进行抛光,所有处理组的Ra值均高于0.5 μm,因此推断出需要使用硅树脂抛光车针例如Brownies®和Greenies®来进一步抛光种植体的粗糙表面。一些种植体表面成形术的临床研究也在使用了钨钢、金刚砂或阿肯色车针后继续使用硅树脂抛光车针进行进一步抛光 (Romeo et al. 2005, 2007; Schwarz et al. 2011, 2014;Meier et al. 2012; Matarasso et al. 2014),但这些研究并没有对抛光后的最终粗糙度进行测量。
种植体表面成形术中初始使用的车针(例如钨钢和金刚砂车针)硬度高于钛,目的是去除种植体表面的污染钛层和螺纹,但这些车针也会产生钛颗粒污染手术区域。使用硅树脂抛光车针如Brownies®和Greenies®也有此问题。此外,硅树脂抛光车针在抛光过程中表面剥脱,还会产生额外的硅碎屑,进而污染种植体周组织。
为了避免使用硅树脂抛光车针,从而最大程度减少碎屑残留的污染,本研究尝试采用特细的实验用金刚砂车针(8和4 μm)和阿肯色石鱼雷状氧化铝车针代替硅树脂抛光车针。使用这些特细的金刚砂车针可使Ra均值达到0.983 μm,使用阿肯色车针代替硅树脂抛光车针可使Ra均值达到0.394 μm。这两者的Ra值均明显高于使用硅树脂抛光车针所达到的Ra值(0.318 μm)。而在特细的金刚砂车针后仅仅使用Greenie®车针也并不能有效降低Ra值。我们的研究表明在模拟临床条件下,要想获得特别光滑的表面,就非常有必要同时使用Brownies®和Greenies®车针。另一方面,临床医生也需要考虑使用Brownies®和Greenies®车针抛光种植体表面时在术区产生的硅碎屑污染问题。鉴于以阿肯色车针(Ra: 0.394)代替硅树脂抛光车针(Ra: 0.318)仅造成Ra值的略微差异,从临床角度看使用阿肯色车针即AS步骤仍然是非常有利的。而对于种植体表面成形术中不同碎屑的生物毒性及其临床后果,还需进一步研究证实。
在本研究中,使用硅树脂抛光车针、阿肯色石车针或特细金刚砂车针均能够有效抛光SLA表面。但是临床中,对种植体周围炎骨上袋的病例采取种植体表面成形术是否能够使其Ra值达到或接近阈值(<0.2 μm),仍然未知(Bollen et al. 1996; Quirynen et al. 1996)。本研究表明在模拟临床环境下, 6种方法均未能达到这个阈值,而预成的抛光颈部部分的Ra均值为0.103±0.011μm。由此推论,也许这个粗糙度阈值仅能在标准化的工业条件下达到。
在临床实际中,种植体表面成形术主要是为了去除钛种植体最外层的玷污层,获得一个理想的光滑的无菌表面,从而不再需要对种植体周围炎骨上袋中种植体暴露的部分进行进一步的抗菌治疗。同时,去除种植体螺纹后形成的种植体外形,也更有利于患者进行口腔卫生的维护。很多研究也证明了降低种植体表面粗糙度能有效减少菌斑的形成(Teughels et al. 2006)。Quirynen等在1993年的临床研究中对比了粗糙基台(Ra值0.8 μm)和标准基台(Ra值0.3 μm),发现3个月后粗糙基台的龈上部分有更成熟的龈上菌斑,同时粗糙基台龈下部分的细菌量比标准基台高出25倍。另一个最近的临床前期研究建立了种植体周围炎的动物狗模型,即在种植体周围用结扎线诱导种植体周围炎, 4个月达到40%的骨丧失,然后在去除结扎线5个月后,观察比较标准SLA种植体(Sa: 2.29 μm)和光滑表面种植体(Sa:0.35 μm)周围的骨改变。此研究发现,光滑表面的种植体并没有发生进一步的骨丧失,而标准SLA种植体却发生了进一步的骨丧失。组织学检查发现标准SLA种植体相比光滑表面种植体,其骨丧失更多,软组织炎症范围更广(Berglundh et al. 2007)。此结果证实了光滑表面种植体相比粗糙表面种植体,更具有种植体周围炎的自限能力,这也在一定程度上支持了种植体表面成形术在种植体周围炎控制上的应用价值。
种植体周围炎会引起骨丧失,其产生和治疗是临床的一大难题。本研究的局限之一在于仅关注骨上袋病变部分的处理,而实际上骨下袋也是临床常见的病变,需要通过GBR来治疗因感染所引起的骨丧失(Schwarz et al.2011, 2014; Matarasso et al.2014)。 并 且种植体表面成形术后,菌斑粘附和集聚的反应机理也尚不清楚。
另外,抛光后种植体的机械稳定性仍需要进一步的研究。骨丧失会导致位于骨嵴上方的种植体部分承受更大的机械应力。而种植体表面成形术后,种植体直径明显减小,剩余的种植体部需要承担额外的应力。因此,需要更进一步利用细胞培养技术研究成形术后种植体表面的生物相容性以及确定种植体的机械稳定性。
另一需要考虑的临床重要因素就是治疗所需的时间。本研究中各组的处理时间不同,在12到21分钟范围内,其中SDG、 AS和SD组处理时间较短。临床医师需要尽量缩短种植体表面成形术的处理时间(Sharonet al. 2013)。因此需要在最终的表面粗糙度和治疗处理时间之间寻找一个较佳的平衡点。
结论
本实验在综合考虑了处理时间、碎屑产生和最终表面粗糙度这些因素后,推荐首先使用106 μm粒度的金刚砂车针,接着用40和15 μm粒度金刚砂车针,最后用阿肯色石鱼雷状氧化铝车针来代替硅树脂抛光车针进行种植体表面成形术(即AS组)。而在种植体表面成形术后,种植体表面的生物相容性、成形术过程中产生碎屑的生物毒性、种植体的断裂强度以及在临床上评估最终粗糙度、耗费时间和术后种植体的长期稳定性都还尚需要进一步研究。
参考文献
Albrektsson, T. & Isidor, F. (1994) Consensus report of session IV. In: Lang,N.P. & Karring, T., eds. Proceedings of the First European Workshop onPeriodontology, 365–369. London: Quintessence.
Berglundh, T., Gotfredsen, K., Zitzmann, N.U., Lang, N.P. & Lindhe, J.(2007) Spontaneous progression of ligature induced peri-implantitis atimplants with different surface roughness: an experimental study in dogs.Clinical Oral Implants Research 18: 655–661.
Bollen, C.M., Papaioanno, W., Van Eldere, J., Schepers, E., Quirynen, M. &van Steenberghe, D. (1996) The influence of abutment surface roughnesson plaque accumulation and peri-implant mucositis. Clinical Oral Implants Research 7: 201–211.
Dohan Ehrenfest, D.M., Vazquez, L., Park, Y.J., Sammartino, G. & Bernard,J.P. (2011) Identification card and codification of the chemical and morphological characteristics of 14 dental implant surfaces. The Journal ofOral Implantology 37: 525–542.
Galindo-Moreno, P., Fauri, M., Ávila-Ortiz, G., Fernández-Barbero, J.E.,Cabrera-León, A. & Sánchez-Fernández, E. (2005) Influence of alcoholand tobacco habits on peri-implant marginal bone loss: a prospectivestudy. Clinical Oral Implants Research 16: 579–586.
Heitz-Mayfield, L.J.A. (2008) Peri-implant diseases: diagnosis and risk indicators. Journal of Clinical Periodontology 35: 292–304.
Levignac, J. (1965) L’ostéolyse périimplantaire, Périimplantose-Périmplantite. Revue Francaise d’Odonto-Stomatologie 12: 1251–1260.
Matarasso, S., Iorio Siciliano, V., Aglietta, M., Andreuccetti, G. & Salvi, G.E.(2014) Clinical and radiographic outcomes of a combined resective andregenerative approach in the treatment of peri-implantitis: a prospectivecase series. Clinical Oral Implants Research 25: 761–767.
Meier, R.M., Pfammatter, C., Zitzmann, N.U., Filippi, A. & Kühl, S. (2012)Surface quality after implantoplasty. Schweizer Monatsschrift für Zahnmedizin 122: 714–724.
Mombelli, A., Müller, N. & Cionca, N. (2012) The epidemiology of peri-implantitis. Clinical Oral Implants Research 23(Suppl. 6): 67–76.
Mombelli, A., van Oosten, M.A., Schürch, E. & Lang, N.P. (1987) Themicrobiota associated with successful or failing osseointegrated titaniumimplants. Oral Microbiology and Immunology 2: 145–151.
Quirynen, M., Bollen, C.M., Papaioannou, W., Van Eldere, J. & van Steenberghe, D. (1996) The influence of titanium abutment surface roughnesson plaque accumulation and gingivitis: short-term observations. International Journal of Oral Maxillofacial Implants 11: 169–178.
Quirynen, M., van der Mei, H.C., Bollen, C.M., Schotte, A., Marechal, M.,Doornbusch, G.I., Naert, I., Busscher, H.J. & van Steenberghe, D. (1993) An in vivo study of the influence of the surface roughness of implants onthe microbiology of supra- and subgingival plaque. Journal of Dental Research 72: 1304–1309.
Renvert, S., Polyzois, I. & Claffey, N. (2012) Surgical therapy for the controlof peri-implantitis. Clinical Oral Implants Research 23(Suppl 6): 84–94.
Roccuzzo, M., Bonino, F., Aglietta, M. & Dalmasso, P. (2012) Ten-year results of a three arms prospective cohort study on implants in periodontallycompromised patients. Part 2: clinical results. Clinical Oral Implants Research 23: 389–395.
Roccuzzo, M., De Angelis, N., Bonino, L. & Aglietta, M. (2010) Ten-yearresults of a three arms prospective cohort study on implants in periodontally compromised patients. Part 1: implant loss and radiographic boneloss. Clinical Oral Implants Research 21: 490–496. Epub 2010 Mar 11.
Romeo, E., Ghisolfi, M., Murgolo, N., Chiapasco, M., Lops, D. & Vogel, G.(2005) Therapy of periimplantitis with resective surgery. A 3-year clinicaltrial on rough screw-shaped oral implants. Part I: clinical outcome. Clinical Oral Implants Research 16: 9–18.
Romeo, E., Lops, D., Chiapasco, M., Ghisolfi, M. & Vogel, G. (2007) Therapy of peri-implantitis with resective surgery. A 3-year clinical trial onrough screw-shaped oral implants. Part II: radiographic outcome. ClinicalOral Implants Research 18: 179–187.
Schwarz, F., Sahm, N. & Becker, J. (2014) Combined surgical therapy of advanced peri-implantitis lesions with concomitant soft tissue volume augmentation. A case series. Clinical Oral Implants Research 25: 761–767.
Schwarz, F., Sahm, N., Iglhaut, G. & Becker, J. (2011) Impact of the method of surface debridement and decontamination on the clinical outcomefollowing combined surgical therapy of peri-implantitis: a randomizedcontrolled clinical study. Journal of Clinical Periodontology 38: 276–286.
Sharon, E., Shapira, L., Wilensky, A., Abu-Hatoum, R. & Smidt, A. (2013) Efficiency and thermal changes during implantoplasty in relation to burtype. Clinical Implant Dentistry and Related Research 15: 292–296.
Suh, J.J., Simon, Z., Jeon, Y.S., Choi, B.G. & Kim, C.K. (2003) The use ofimplantoplasty and guided bone regeneration in the treatment of peri-implantitis: two case reports. Implant Dentistry 12: 277–282.
Teughels, W., Van Assche, N., Sliepen, I. & Quirynen, M. (2006) Effect ofmaterial characteristics and/or surface topography on biofilm development. Clinical Oral Implants Research 17(Suppl. 2): 68–81.
Wennerberg, A. & Albrektsson, T. (2000) Suggested guidelines for the topographic evaluation of implant surfaces. International Journal of Oral andMaxillofacial Implants 15: 331–344.



